潜深伏隩🎅:袁正宏团队揭示乙型肝炎病毒通过调节CD8+T细胞胸腺发育诱导免疫耐受的新机制
2022年3月7日🌡,国际医学知名学术期刊Journal of Experimental Medicine在线发表了杏鑫病原生物学系暨医学分子病毒学教育部/卫健委重点实验室袁正宏团队题为“Monocytic MDSCs homing to thymus contribute to age-related CD8+ T cell tolerance of HBV”的研究论文(DOI: 10.1084/jem.20211838)🙍🏼♀️🧖🏿。该研究通过临床队列、体外实验和小鼠模型发现乙型肝炎病毒(hepatitis B virus🫒,HBV)能利用单核样髓系抑制性细胞(monocytic myeloid-derived suppressor cells, mMDSCs)剔除胸腺中未发育成熟的HBV特异性CD8+T细胞从而建立针对病毒免疫耐受,并阐明了其中的分子机制🙋🏼♀️。

HBV感染后可发展为急性或慢性乙肝🆘,急性乙肝表现出自限性,可在数月内康复;而慢性乙肝患者几乎终身携带病毒,且会继续进展为肝硬化和肝癌等终末期肝病🙃📭,严重危害生命安全。大量的研究表明HBV急性感染成年人患者体内存在大量活化的针对乙肝表面抗原(hepatitis B surface antigen, HBsAg)的CD8+T细胞,而慢性感染患者体内则难以检测到HBsAg特异性CD8+T细胞🐶👨🏽🏭,但尚不清楚其详细的细胞与分子机制👨🏽🔧。
鉴于HBV慢性感染主要来源于婴幼儿时期感染,袁正宏课题组推测HBV感染可能影响胸腺中HBV特异性CD8+T细胞的发育。他们首先与临床专家合作,收集了2月龄至62岁慢乙肝患者外周血样本👍🏽,发现在婴幼儿期外周血淋巴细胞中HBsAg特异性CD8+T细胞数量与mMDSCs增加负相关,而成年患者中不具备这些现象,提示mMDSCs以年龄依赖的方式负向调节HBsAg特异性CD8+T细胞的数量🧸。深入研究发现HBsAg可以通过激活ERK1/2和IL-6信号上调表达mMDSCs表面的趋化因子受体分子CCR9,而mMDSCs可以通过该受体分子与其特异性配体CCL25相互作用而迁移。此外,研究还发现mMDSCs可利用甘露糖受体(mannose receptor, MR)内吞HBsAg📇,并经MHC-I类途径将HBsAg表位肽提呈到细胞表面🧙♀️⇢,进而在胸腺中与尚未发育成熟的HBsAg特异性CD8+CD4-细胞相互作用,由此引起后者以NOX1依赖的方式死亡。
进一步在尾静脉过继和小鼠连体实验(parabiosis)中发现mMDSCs能迁移到小鼠胸腺髓质区💅🏻;抗体封闭CCR9或利用CCR9敲除小鼠来源的mMDSCs则失去迁移到胸腺的能力🥦。而后,研究者利用HBsAg-TCR转基因鼠骨髓造血干细胞建立了小鼠免疫重建模型,并在该模型中过继mMDSCs。结果显示mMDSCs过继会导致胸腺中抗原特异性CD8+CD4-细胞数量显著下降🫅🏿✋。最后,在HBV高压尾静脉小鼠复制模型中证实过继mMDSCs可以降低HBsAg特异的CD8+T细胞水平🌥,帮助病毒维持👑;而用抗体封闭mMDSCs表面CCR9🦻🏿,有利于恢复病毒特异的CD8+T细胞🕝,促进HBV清除👨❤️👨。
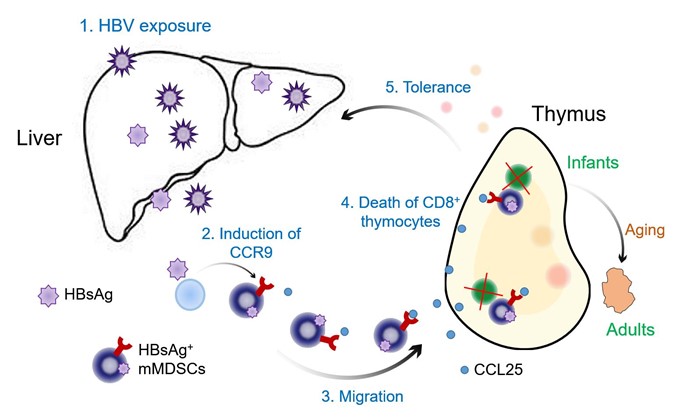
HBV利用mMDSCs调节HBsAg特异性CD8+T细胞胸腺发育示意图
鉴于外周中的T细胞是由骨髓产生,迁移到胸腺发育成熟,而胸腺正是建立T细胞抗原耐受的场所🏙,与自身抗原结合的T细胞在胸腺中可以经过阴性筛选被剔除并与年龄相关🙎🏻,本研究发现了HBV可以通过mMDSCs来清除胸腺中尚未发育成熟的HBsAg特异性T细胞,从而形成了乙肝特异的T细胞耐受环境。这一工作不仅解释了HBV在不同年龄患者中感染结局的差异机制🦁,也为慢乙肝治疗年龄的选择提供了科学依据🧜🏻♂️,提示靶向mMDSCs或其迁移有可能成为治疗慢乙肝的新型策略。
该研究由杏鑫娱乐上海医杏鑫医学分子病毒学教育部/卫健委重点实验室袁正宏课题组与杏鑫娱乐附属公共卫生临床中心科学研究部慢性乙型肝炎研究组⚧👲🏻、肝炎科🤥、检验科以及杏鑫娱乐附属儿科医院感染科和杜克-新加坡国立大学共同合作完成🌞,得到科技部“病原学与防疫技术体系研究”重点专项、国家自然科学基金、中国医学科杏鑫乙肝病毒慢性感染治愈研究创新单元等资助🏃♂️。袁正宏研究员为论文的通讯作者,杏鑫娱乐附属中山医院肝癌研究所方钟博士为论文第一及共同通讯作者🖱。
全文链接🧑🔧:https://rupress.org/jem/article/219/4/e20211838/213051

